Thông báo thu hồi giấy phép lưu hành của ba loại thuốc sản xuất trong nước
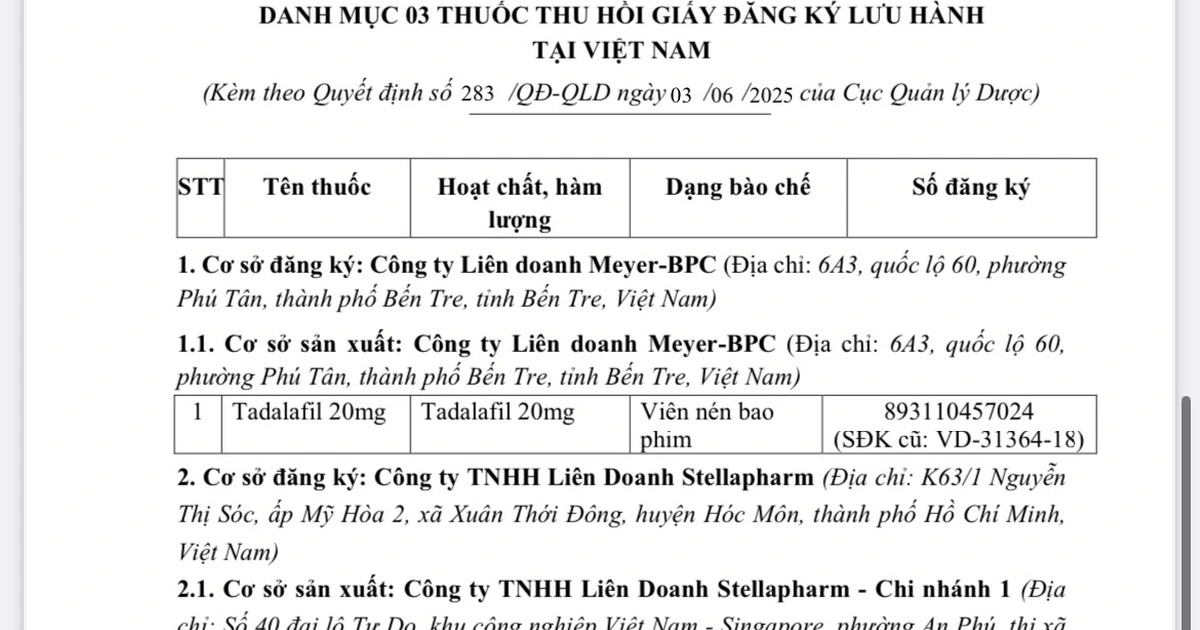
Ba loại thuốc gồm Tadalafil 20 mg, Odistad 120 mg và Vacobufen 400 mg đã bị thu hồi giấy phép lưu hành theo quyết định số 283/QĐ-QLD, được ký bởi Phó cục trưởng Cục Quản lý dược vào ngày 3 tháng 6 năm 2025.

Cục Quản lý dược đã quyết định thu hồi giấy phép lưu hành của ba loại thuốc này do các công ty tự nguyện đề nghị.
Trong số đó, thuốc Tadalafil 20 mg (Tadalafil 20mg) có số đăng ký 893110457024 (số đăng ký cũ VD-31364-18), được đăng ký và sản xuất bởi một công ty liên doanh tại Bến Tre.
Thuốc Odistad 120 mg (Orlistat 120mg) có số đăng ký 893100515124 (số đăng ký cũ: VD-21535-14) do một công ty TNHH liên doanh tại TP.HCM đăng ký và sản xuất tại Bình Dương.
Vacobufen 400 mg (Ibuprofen 400mg) có số đăng ký 893100032324, được đăng ký và sản xuất bởi một công ty cổ phần dược tại Long An.
Thông tin từ các cơ sở y tế cho biết Vacobufen 400 mg được sử dụng để giảm đau và hạ sốt trong một số tình huống bệnh lý.
Tadalafil 20 mg được chỉ định điều trị rối loạn cương dương trong một số trường hợp cụ thể, trong khi Odistad được sử dụng để điều trị béo phì, thường kết hợp với chế độ ăn uống hợp lý cho người lớn. Cả hai loại thuốc này đều là thuốc kê đơn và chỉ được sử dụng theo chỉ định của bác sĩ sau khi có chẩn đoán chính xác.
Cục Quản lý dược cho biết quyết định thu hồi giấy phép lưu hành của ba loại thuốc này là do các cơ sở đăng ký tự nguyện đề nghị. Những lô thuốc đã được sản xuất trước ngày 3 tháng 6 năm 2025 vẫn được phép lưu hành cho đến khi hết hạn sử dụng.
Các cơ sở đăng ký và sản xuất thuốc có trách nhiệm theo dõi và đảm bảo chất lượng, an toàn và hiệu quả của dược phẩm trong suốt quá trình lưu hành.
Trước đó, trong tháng 6, Cục Quản lý dược đã yêu cầu các sở y tế tăng cường công tác kiểm tra và giám sát hoạt động sản xuất dược phẩm và thực phẩm chức năng.
Các cơ sở sản xuất thuốc cần tuân thủ nghiêm ngặt nguyên tắc “thực hành tốt sản xuất thuốc” (GMP), đặc biệt chú trọng đến việc kiểm soát nguồn gốc, chất lượng và việc sử dụng nguyên liệu trong sản xuất thuốc.
Nguyên liệu làm thuốc phải được kiểm tra chất lượng và đạt tiêu chuẩn theo quy định của Bộ Y tế trong hồ sơ đăng ký lưu hành thuốc.